2.Teoría cinético-molecular
Introducción
El comportamiento de la materia y de los gases se explica actualmente con la teoría cinética basada en los siguientes supuestos:
-La materia está compuesta por partículas muy pequeñas en continuo movimiento, entre ellas hay espacio vacío.
-Las partículas pueden ser átomos, moléculas, iones...
-La energía cinética de las partículas aumenta al aumentar la temperatura.
-Las partículas se mueven en todas las direcciones. En el caso de un gas chocan continuamente entre ellas y con las paredes del recipiente que lo contiene.
-La cantidad de choques que por unidad de tiempo se producen sobre las paredes del recipiente está relacionado con la presión (a mayor número de choques, más presión se ejerce sobre las paredes del recipiente).
-Las partículas interaccionan entre sí con fuerzas de mayor o menor intensidad
Propiedades de la materia
Las propiedades de la materia pueden ser a su vez:
- Propiedades extensivas, que dependen de la cantidad de materia presente (como la masa y el volumen), y
- Propiedades intensivas, que no dependen de la cantidad de materia (como la dureza y la densidad).
Propiedades intensivas y extensivas de la materia
La materia es todo aquello que nos rodea. Las propiedades intensivas y extensivas se refiere a la clasificación de las propiedades según su dependencia en la cantidad de materia. Veamos cada una por separado.
Definición de propiedades intensivas
Son aquellas propiedades que no dependen de la cantidad o tamaño del material. También se conocen como propiedades intrínsecas o locales.
Imaginemos que tenemos un sistema con una propiedad X. Si dividimos el sistema en partes A, B y C, la propiedad X de A es igual a la propiedad X de B y de C:
Clave para recordar si una propiedad es intensiva: la propiedad de las partes es igual a la propiedad del sistema.
Ejemplos de propiedades intensivas
A continuación, presentamos algunas de las propiedades intensivas más conocidas.
1. Temperatura

La temperatura es la medida de la energía cinética promedio de los átomos. La escala Celsius, o centígrado, es la escala más usada a nivel mundial para medir la temperatura.
Es una propiedad intensiva porque si medimos la temperatura de un litro de agua o de un vaso de agua en las mismas condiciones, la medida será igual.
2. Punto de fusión
El punto de fusión es la temperatura a la que un compuesto en fase sólida pasa a su fase líquida. En el sistema internacional la unidad es el kelvin (K). También se puede expresar en grados centígrados.
Es una propiedad intensiva porque no depende de la cantidad de material. La temperatura a la que un gramo de una sustancia se funde será igual a la temperatura que se funde un kilogramo de la misma sustancia. Por ejemplo, el oro tiene un punto de fusión de 1.064ºC; así que 1 gramo de oro o un lingote de oro tienen que alcanzar la temperatura de 1.064ºC para pasar del estado sólido al líquido.
3. Punto de ebullición
El punto de ebullición es la temperatura a la que un compuesto en fase líquida pasa a su fase gaseosa. El ejemplo típico es el del agua, que hierve y se transforma en vapor a 100ºC cuando la presión atmosférica es igual a 1 atmósfera.
Por ejemplo, la destilación es una técnica que aprovecha la diferencia en los puntos de ebullición de los compuestos para poder separarlos, como el caso del alcohol y el agua.
4. Elasticidad

La elasticidad es una medida de cuánto se puede deformar un objeto cuando se le aplica una cierta fuerza. Materiales como la goma tienen una propiedad elástica mayor. Es una propiedad intensiva porque un metro de goma tiene la misma elasticidad que 10 centímetros de goma.
5. Densidad
La densidad es la relación entre la masa de un cuerpo o material y el volumen que ocupa. Se calcula dividiendo la cantidad de masa en gramos entre el volumen en mililitros.
Es una propiedad intensiva pues la densidad no varía ya sea si la medimos en un kilogramo de materia, o en dos toneladas de la misma.
6. Viscosidad
La viscosidad es la propiedad de los fluidos para resistirse a fluir. Mientras más viscoso es un fluido, será más espeso. La viscosidad en los fluidos generalmente disminuye con el aumento de la temperatura.
La viscosidad se mide en newtons-segundos por metro cuadrado (N-s/m2). Otra unidad usada comúnmente para la viscosidad es el poise (P), siendo que 10 P equivale a 1 N-s/m2
La viscosidad de la miel a una determinada temperatura es la misma independiente de su cantidad.
7. Tensión superficial

La tensión superficial es la propiedad de los líquidos a resistir las fuerzas que se aplican sobre su superficie. Esta propiedad es resultado de las fuerzas que mantienen juntas a las moléculas del líquido en la superficie.
Es una propiedad intensiva porque las fuerzas intermoleculares son iguales sobre toda la superficie del fluido.
8. Calor específico

El calor específico es una propiedad intensiva que describe cuanto calor se necesita para aumentar la temperatura de una unidad de masa de un material. En el sistema internacional la unidad del calor específico es Joules por kilogramo centígrado (J/kg ºC).
El calor específico del agua (4186 J/kg ºC) es cinco veces mayor que el del vidrio (840 J/kg ºC). Esto significa que se requiere cinco veces más calor para aumentar la temperatura de un kilo de agua que de un kilo de vidrio.
9. Resistividad

La resistividad es la propiedad de un material de resistir el flujo de cargas eléctricas, independiente de su tamaño o forma. En el sistema internacional la unidad para la resistividad es ohm metro (Ω·m)
10. Conductividad térmica
La conductividad térmica es la capacidad de los materiales para transferir el calor. En el sistema internacional de unidades se mide en vatios por metro y kelvin (W/m.k)
Definición de propiedades extensivas
Son aquellas propiedades que dependen del tamaño del sistema. En este caso, si dividimos un sistema en partes A, B y C, entonces la propiedad del sistema será igual o mayor a la suma de las partes:
Clave para recordar si una propiedad es extensiva: la propiedad de las partes se suma a la propiedad del sistema. La relación o cociente de dos propiedades extensivas se transforma en una propiedad intensiva. Por ejemplo, la densidad es la división de dos propiedades extensivas: la masa y el volumen.
Ejemplo de propiedades extensivas
A continuación se presentan algunas propiedades extensivas.
11. Longitud

La longitud es una medida física de la distancia: la separación entre dos objetos, el espacio que un objeto se mueve, la largura de un cable y otras medidas dependen de la distancia. La unidad del sistema internacional para la longitud es el metro.
Es una propiedad extensiva porque depende del tamaño: si cortamos una cuerda de diez metros en trozos de un metro, la longitud de los trozos finales no es igual al original.
12. Masa

La masa es la cantidad de materia que contiene un objeto. La masa, a diferencia del peso, no depende de la gravedad. La unidad del sistema internacional para la masa es el kilogramo.
Es una propiedad extensiva porque al quitar un pedazo del material que se está midiendo, la medida final de masa cambia.
13. Volumen
El volumen es la medida del espacio tridimensional que ocupa un objeto. En el sistema internacional la unidad de volumen es el metro cúbico (m3). También se usa el litro. El volumen de un sólido se puede medir por el volumen de líquido que puede desplazar cuando es sumergido completamente.
Es una propiedad extensiva porque al añadir más material a un recipiente el volumen cambia, aunque sea el mismo material.
14. Número de moléculas

El número de moléculas de un material varia en función de la cantidad del material. Sabemos que un mol de una sustancia tiene 602.000.000.000.000.000.000.000 moléculas, en notación científica sería 6,02x1023, este número también se conoce como el número de Avogadro.
Es una propiedad extensiva pues el número de moléculas aumenta o disminuye dependiendo si hay mas o menos material.
15. Inercia
La inercia es la propiedad de los cuerpos para resistir a los cambios de movimiento o reposo. Es una propiedad asociada a la masa, mientras más masa, más inercia. Es una propiedad extensiva pues depende de la cantidad de material, la inercia de un carrito de juguete es menor que la inercia de un coche. Por ejemplo, si colocamos unos libros sobre una silla con rueditas y la empujamos contra una pared, los libros continúan por inercia su movimiento cuando ésta choca contra la pared.
16. Capacidad calorífica

La capacidad calorífica es la cantidad de calor necesaria para cambiar la temperatura de una sustancia. En el sistema internacional la unidad de la capacidad calorífica es joules por kelvin (J/K).
Es una propiedad extensiva, pues depende de la cantidad de sustancia, además de la temperatura y presión. Para calentar 10 litros de agua se requiere más calor que para calentar una taza de agua.
17. Entalpía
La entalpía es la cantidad de energía que un sistema cede o absorbe de su alrededor. En el sistema internacional la unidad de entalpía es joules (J).
Por ejemplo, La reacción del rubidio con el agua libera una gran cantidad de calor.
18. Entropía
La entropía es la medida del desorden de un sistema. En el sistema internacional la unidad de entropía es joules por kelvin (J/K).
Es una propiedad extensiva pues a mayor tamaño del sistema mayor será el desorden. La tendencia en la naturaleza es el desorden.
19. Carga eléctrica

La carga eléctrica es una propiedad que produce fuerzas que pueden atraer o repeler materia. En el sistema internacional la unidad de carga es el Coulomb (C), el cual representa 6,242x1018e, donde e es la carga del protón. La carga puede ser positiva o negativa.
20. Resistencia
La resistencia es la propiedad eléctrica que impide el paso de la corriente. En el sistema internacional la unidad de resistencia se mide en Ohm. La resistencia de un objeto depende de su forma y longitud.
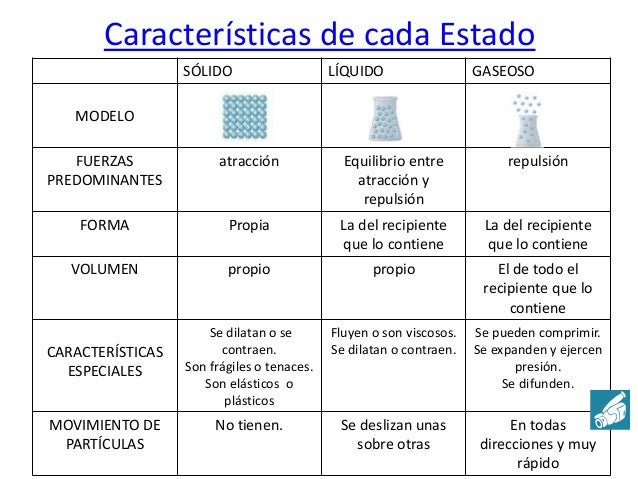
Los estados de agregación y la teoría cinética
La teoría cinética es capaz de explicar porqué una misma sustancia se puede encontrar en los 3 estados: sólido, líquido y gas. Esto depende sólo de la manera de agruparse y ordenarse las partículas en cada estado.
Estado sólido: La teoría cinética explica este estado como puede verse en esta página web y en esta otra.
Estado líquido: La teoría cinética explica este estado en esta página web y en esta otra.
Estado gaseoso: La teoría cinética lo explica como puede verse aquí y en esta otra página.

No hay comentarios:
Publicar un comentario