Física
domingo, 31 de enero de 2021
sábado, 20 de junio de 2020
PROYECTO FINAL MATEMÁTICAS Y FÍSICA
Alejandro Paredes A.
1º de secundaria
Montaña Rusa
MATEMÁTICAS
Alejandro García P.
2º de secundaria
Horno solar
Física
Santiago Ramírez V.
3º de secundaria
Teorema de Pitágoras
Matemáticas
Danna Zoé Amado L.
3º de secundaria
¿Sabes contar?
Matemáticas
Rodrigo Moreno B
2º de secundaria
3a Ley de Newton
Física
Disfrútenlo
domingo, 7 de junio de 2020
Semana del 8 al 12 de junio 2020
Les comunico que a partir de esta semana tendremos clase en línea por ZOOM los jueves de 12:00 a 13:00 para resolver dudas relacionadas con los temas vistos durante esta pandemia. Los espero a todos. Gracias
Les dejo el ID de la reunión: 771 7529 3927
Contraseña: BF
Les dejo el ID de la reunión: 771 7529 3927
Contraseña: BF
sábado, 30 de mayo de 2020
Semana del 1 al 5 de junio 2020
BLOQUE TEMÁTICO:
|
Bloque III. Materia, energía e interacciones
|
TEMA:
|
Interacciones
|
SUBTEMAS:
|
15.- Electricidad y magnetismo: ondas electromagnéticas
|
LECCIÓN:
|
3.-
Generación de ondas electromagnéticas.
|
APRENDIZAJES ESPERADOS:
|
• Describe la generación, diversidad y comportamiento de las ondas
electromagnéticas como resultado de la interacción entre electricidad y
magnetismo
|

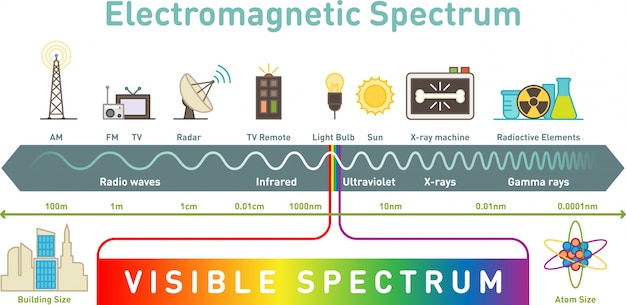
TAREA PARA ENTREGAR EL VIERNES 5 DE JUNIO
RESPONDE EL SIGUIENTE CUESTIONARIO
1. Describe qué es el Espectro Electromagnético
2. Qué es el espectro visible del espectro electromagnético
3. Hay ondas electromagnéticas cuya longitud de onda es tan grande como el Monte Everest. Si estas ondas viajan por el aire, por qué no podemos verlas?
4. Los científicos afirman que los rayos gamma son peligrosos pero dicen que las ondas de radio son inofensivas. Si ambas son ondas electromagnéticas, por qué su efecto sobre nuestra salud es diferente?
5. De qué está compuesta la luz blanca?
6. Cuál es el rango de longitudes de onda que puede detectar el ojo humano?
7. Cuáles son las ondas electromagnéticas que tienen mayor energía? Y las que tienen menor energía?
8. Explica brevemente (pero que se entienda) la función de la antena de una estación de televisión como la de Televisa para que puedas ver tu TV en casa.
9. Dibuja la figura 3.28 en tu cuaderno que sea de tamaño de, por lo menos, media hoja
sábado, 23 de mayo de 2020
Semana del 25 al 29 mayo 2020
|
BLOQUE TEMÁTICO:
|
Bloque III. Materia, energía e interacciones
|
|
TEMA:
|
Interacciones
|
|
SUBTEMAS:
|
15.- Electricidad y magnetismo: ondas electromagnéticas
|
|
LECCION:
|
1.-
Relación entre electricidad y magnetismo
|
|
APRENDIZAJES ESPERADOS:
|
• Describe la generación, diversidad y comportamiento de las ondas
electromagnéticas como resultado de la interacción entre electricidad y
magnetismo
|
TAREA PARA ENTREGAR EL VIERNES 29 DE MAYO
1. Qué relación existe entre un campo eléctrico y uno magnético?
2. Que es una espira?
3. Describe lo que son los imanes atómicos
4. Explica por qué no todos los materiales son imanes si tienen átomos que generan campos magnéticos?
5. Construye un electroimán y me mandas el video, haz que te ayuden tus padres. Te anexo un video, pero puedes hacerlo como mejor te convenga. Espero que tengas los materiales, si no los tienes, que es lo que me vas a decir, pues no lo hagas. Pero aun sin haber hecho el electroimán, contesta cómo es que se imanta el tornillo. Adiós
sábado, 16 de mayo de 2020
Semana del 18 al 22 mayo 2020
|
BLOQUE TEMÁTICO:
|
Bloque III. Materia, energía e interacciones
|
|
TEMA:
|
Interacciones
|
|
SUBTEMAS:
|
14.- Corriente eléctrica y magnetismo
|
|
LECCION:
|
2.-
Electromagnetismo
|
|
APRENDIZAJES ESPERADOS:
|
• Describe, explica y experimenta con algunas manifestaciones y
aplicaciones de la electricidad e identifica los cuidados que requiere su
uso.
|
Interacción Eléctrica, los imanes.

Aplicaciones del magnetismo
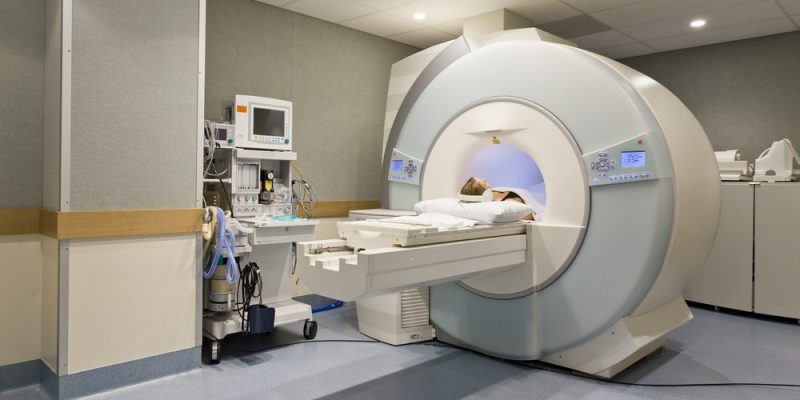
El magnetismo ha sido empleado por la humanidad desde hace mucho.
Como dijimos antes, la invención de la brújula y su uso para orientarse (marcando la dirección fija del Norte del planeta) data de hace cientos de años, y fue clave en el desarrollo de la navegación y en la exploración del mundo.
Por otro lado, grandes imanes se emplean en la industria de la generación eléctrica, en la medicina (por ejemplo, los exámenes por resonancia magnética), en la ingeniería (el desarrollo de motores, la conducción y almacenamiento de cargas eléctricas, etc.) y sobre todo en la electrónica.
La computación, por ejemplo, depende en gran medida del aprovechamiento del magnetismo para el registro de información, combinándolo con la corriente eléctrica y el conocimiento de los semiconductores.
TAREA PARA ENTREGAR EL VIERNES 22 MAYO
SI ACASO NO ENCUENTRAS LA RESPUESTA EN LOS TEXTOS QUE TE ANEXÉ, COMO A 2 Ó 3 PREGUNTAS, LAS INVESTIGAS.
1) Electricidad y
Magnetismo, son aspectos diferentes de un mismo fenómeno. ¿Es esto verdadero o
falso?
2) ¿A qué se denomina imán?
3) ¿Qué tipos de imanes hay?
4) De dos ejemplos de imanes naturales
5) ¿Con qué elemento se fabrican los imanes artificiales?
6) ¿Cuáles son los mejores imanes artificiales?
7) ¿Por qué no se utilizan imanes de Hierro puro?
8) ¿Cómo se llaman los polos de un imán?
9) En el Polo Norte Geográfico del planeta Tierra, es decir en el Artico, ¿Qué polo magnético se encuentra allí?
10) En el Polo Sur Geográfico del planeta Tierra, es decir en la Antártida, ¿Qué polo magnético se encuentra allí?
11) Las líneas de campo magnético, ¿Qué trayectoria siguen, es decir, de donde a dónde
12) En el planeta
Tierra, ¿De dónde a dónde van las líneas de campo magnético?
13) ¿Cuál es la unidad
de medida el campo magnético en el Sistema Internacional?
14) ¿Es posible tener
“aislado” un solo polo magnético o monopolo magnético?
15) ¿Cómo es la
clasificación de las sustancias en términos de sus propiedades magnéticas?
16) REALIZA UNO DE LOS EXPERIMENTOS DE LOS VIDEOS 2 Y 3. LO GRABAS Y ME LO ENVÍAS. (PARA AYUDARTE EN TU CALIFICACIÓN EN CASO DE QUE LO NECESITES)sábado, 9 de mayo de 2020
Semana del 11 al 15 de mayo 2020
BLOQUE TEMÁTICO:
|
|
TEMA:
|
Interacciones
|
SUBTEMAS:
|
14.- Corriente eléctrica y magnetismo
|
LECCIÓN:
|
1.-
Corriente eléctrica y magnetismo
|
APRENDIZAJES ESPERADOS:
|
• Describe, explica y experimenta con algunas manifestaciones y
aplicaciones de la electricidad e identifica los cuidados que requiere su
uso.
|
PILA VOLTAICA
La pila voltaica fue la primera batería eléctrica que pudo suministrar continuamente una corriente eléctrica a un circuito. Fue inventada por el físico italiano Alessandro Volta, quien publicó sus experimentos en 1799.
El desarrollo de la pila voltaica permitió rápidamente realizar experimentos que llevaron a otros descubrimientos incluyendo la descomposición eléctrica (electrólisis) del agua en oxígeno e hidrógeno por William Nicholson y Anthony Carlisle (1800) y el descubrimiento o aislamiento de los elementos químicos sodio (1807), potasio (1807), calcio (1808), boro (1808), bario (1808), estroncio (1808), y magnesio (1808) por Humphry Davy.

Toda la industria eléctrica del siglo XIX estaba alimentada por baterías relacionadas con las desarrolladas por Volta (por ejemplo, la célula Daniell y la célula Grove) hasta la llegada de la dinamo (generador eléctrico) en la década de 1870.
El invento de Volta fue construido a partir del descubrimiento que Luigi Galvani hizo en la década de 1780 de cómo un circuito de dos metales y una pata de rana podían hacer que la pata de rana respondiera. Volta demostró en 1794 que cuando dos metales y tela o cartón empapados en salmuera dispuestos en un circuito, producen una corriente eléctrica.
En 1800, Volta apiló varios pares de discos de cobre (o plata) y zinc (electrodos) alternados separados por tela o cartón empapado en salmuera (electrolito) para aumentar la conductividad del electrolito. Cuando los contactos superior e inferior estaban conectados por un cable, una corriente eléctrica fluía a través de la pila voltaica y el cable de conexión.
Historia de la pila voltaica
En 1780, Luigi Galvani estaba diseccionando una rana fijada a un gancho de latón. Cuando tocó su pierna con su bisturí de hierro, la pierna se movió. Galvani creía que la energía que impulsó esta contracción provenía de la propia pierna, y la llamó “electricidad animal”.

Sin embargo, Alessandro Volta, un amigo y colega científico, no estuvo de acuerdo, y desarrollo la hipótesis que este fenómeno fue causado por dos metales diferentes unidos por un intermediario acuoso. Verificó esta hipótesis a través de experimentos y publicó los resultados en 1791.
En 1800, Volta inventó la primera batería verdadera, que llegó a conocerse como pila voltaica. La pila voltaica consistía en pares de discos de cobre y zinc apilados uno encima del otro, separados por una capa de tela o cartón empapado en salmuera (es decir, el electrolito).

Circuitos:
Abiertos:
Para que la electricidad fluya, tiene que haber un “camino” conductor y continuo
entre el polo negativo y el polo positivo de la fuente de potencia (una batería,
un receptáculo eléctrico, etc.). Un alambre roto o un interruptor abierto (apagado)
ambos dejan huecos en el circuito e impiden que los electrones viajan de un lado
de la fuente de potencia al otro. Por tal razón, los electrones no pueden fluir.
Cuando ocurre esta situación se le llama un circuito abierto.
entre el polo negativo y el polo positivo de la fuente de potencia (una batería,
un receptáculo eléctrico, etc.). Un alambre roto o un interruptor abierto (apagado)
ambos dejan huecos en el circuito e impiden que los electrones viajan de un lado
de la fuente de potencia al otro. Por tal razón, los electrones no pueden fluir.
Cuando ocurre esta situación se le llama un circuito abierto.
Cerrados:
Un interruptor cerrado (prendido) quiere decir que el circuito está conectado a
través del interruptor. Por tal razón, tenemos un circuito cerrado (un circuito sin
huecos). La corriente fluye del polo positivo de la fuente de potencia (por ejemplo,
una batería) hasta llegar a las cargas (bombilla, abanicos, etc.) que están
alambradas al circuito y regresan al polo negativo de la fuente de potencia
través del interruptor. Por tal razón, tenemos un circuito cerrado (un circuito sin
huecos). La corriente fluye del polo positivo de la fuente de potencia (por ejemplo,
una batería) hasta llegar a las cargas (bombilla, abanicos, etc.) que están
alambradas al circuito y regresan al polo negativo de la fuente de potencia
Los conductores son los materiales que permiten el paso de la corriente eléctrica, los aislantes impiden el paso de la electricidad y los semiconductores son los que se pueden comportar como conductores o como aislantes.
| Conductores | Aislantes | Semiconductores | |
|---|---|---|---|
| Definición | Materiales que permiten el movimiento de cargas eléctricas. | Materiales que impiden el paso de cargas eléctricas. | Materiales que pueden permitir e impedir el paso de la energía eléctrica. |
| Funciones | Conducir la electricidad de un punto a otro. | Proteger las corrientes eléctricas del contacto con las personas y con otras corrientes. | Conducir electricidad, solo bajo condiciones específicas y en un sentido. |
| Materiales | Oro, plata, cobre, metales, hierro, mercurio, plomo, entre otros. | Goma, cerámica, plástico, madera, entre otros. | Silicio, germanio, azufre, entre otros. |
Un conductor es un material que, en mayor o menor medida, conduce el calor y la electricidad. Son buenos conductores los metales y malos, el vidrio, la madera, la lana y el aire.
El conductor más utilizado y el que ahora analizaremos es el Cobre (valencia 1), que es un buen conductor. Su estructura atómica la vemos en la siguiente figura.
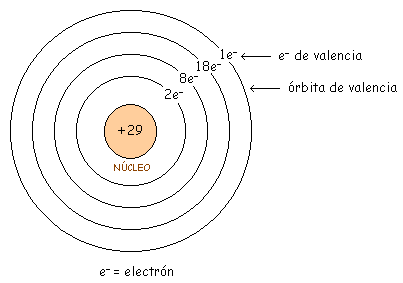
Lo que interesa en electrónica es la órbita exterior, que es la que determina las propiedades del átomo. Como hay + 29 y - 28, queda con + 1.
Por ello vamos a agrupar el núcleo y las órbitas internas, y le llamaremos parte interna. En el átomo de cobre la parte interna es el núcleo (+ 29) y las tres primeras órbitas (- 28), con lo que nos queda la parte interna con una carga neta de +1.
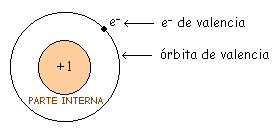
Lo que define a un buen conductor es el hecho de tener un solo electrón en la órbita de valencia (valencia 1).
Voltaje. Denominado también como tensión o diferencia de potencial es una magnitud física que impulsa a los electrones a lo largo de un conductor en un circuito eléctrico cerrado, provocando el flujo de una corriente eléctrica.
La diferencia de potencial también se define como el trabajo por unidad de carga ejercido por el Campo eléctrico, sobre una Partícula cargada, para moverla de un lugar a otro. Se puede medir con un Voltímetro.
En el Sistema Internacional de Unidades, la diferencia de potencial se mide en Voltios ( V ), al igual que el Potencial.
Tensión eléctrica
| |
|---|---|
 | |
| Concepto: | Magnitud física que impulsa a los electrones a lo largo de un conductor en un circuito eléctrico cerrado. |
¿Qué es la Intensidad de Corriente?
Si sabemos que la corriente eléctrica es el flujo de carga entre dos puntos de un material conductor, es lógico que nos podamos preguntar... ¿ y cómo de rápido se desplazan dichas cargas?. Para responder a esta pregunta, la Física establece una nueva magnitud que determina la rapidez con la que la carga fluye a través de un conductor. Dicha magnitud recibe el nombre de intensidad de corriente eléctrica o simplemente intensidad de corriente.
La intensidad de corriente (I) que circula por un conductor es la cantidad de carga (q) que atraviesa cierta sección de dicho conductor por unidad de tiempo (t).
Unidad de Intensidad de Corriente
La intensidad de corriente en el S.I. es el amperio (A), en honor del físico francés André-Marie Ampère (1775-1836). De esta forma un amperio es la intensidad de corriente que se produce cuando por la sección de un conductor circula una carga de un culombio cada segundo.
Tarea para entregar el viernes 15 de mayo
Señala los materiales conductores de la electricidad
En qué unidades se mide la intensidad de corriente?
Suscribirse a:
Entradas (Atom)
Niños felices, escuela feliz, mundo feliz










