El principio de la conservación de la energía establece que el valor de la energía en un sistema sobre el cual no interactúa ningún otro no varía con el tiempo. Aplicando este principio a los sistemas termodinámicos se puede extraer la consecuencia de que el aumento de la cantidad de energía térmica en un sistema es igual a la suma del incremento de la energía interna del sistema y el trabajo.
A mediados del siglo XIX se realizaron los experimentos que demostraron la relación entre el calor y el trabajo. James Joule publicó en 1850 la obra El equivalente mecánico del calor, explicando los experimentos que llevó a cabo y que le permitieron demostrar que la energía producida por el trabajo tiene calor como resultado y puede medirse: existe una relación de equivalencia entre trabajo y calor. La energía suministrada como trabajo se transforma en otro tipo de energía, en calor.
Para sus pruebas ideó un aparato que consistía en un recipiente hermético con un eje rotatorio con ocho paletas que agitaban un líquido. El eje estaba conectado con poleas a dos pesos conocidos. Al dejar caer los pesos, el eje giraba y movía las palas que, a su vez, agitaban el líquido del recipiente. Tras repetir veinte veces el mismo experimento, las conclusiones fueron:
1) El calor producido por la fricción es proporcional a la cantidad de trabajo mecánico existente
2) Es necesaria una fuerza mecánica equivalente a la caída de 772 libras desde la altura de un pie para aumentar en 1ºF la temperatura de una libra de agua

Leer más: http://www.monografias.com/trabajos96/conservacion-energia/conservacion-energia.shtml#ixzz4cPOfw7ke
2) Es necesaria una fuerza mecánica equivalente a la caída de 772 libras desde la altura de un pie para aumentar en 1ºF la temperatura de una libra de agua
Principios de Conservación De la Energía

El Principio de conservación de la energía indica que la energía no se crea ni se destruye; sólo se transforma de unas formas en otras. En estas transformaciones, la energía total permanece constante; es decir, la energía total es la misma antes y después de cada transformación.
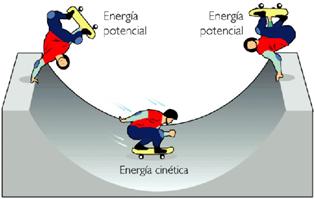
En el caso de la energía mecánica se puede concluir que, en ausencia de rozamientos y sin intervención de ningún trabajo externo, la suma de las energías cinética y potencial permanece constante. Este fenómeno se conoce con el no En todos los casos donde actúen fuerzas conservativas, la energía mecánica total, es decir, la energía cinética más la energía potencial en cualquier instante de la trayectoria es la misma; por ejemplo, la fuerza gravitacional, pues en cualquier trabajo que realice un cuerpo contra la fuerza de gravedad de la Tierra, la energía se recuperará íntegramente cuando el cuerpo descienda.
Em = Ec + Ep
donde Em = energía mecánica total expresada en joules. Sustituyendo las expresiones de las energías:
Em = 1/2mv2 + mgh.
En resumen, "la energía existente en un sistema es una cantidad constante que no se crea ni se destruye, únicamente se transforma". Respecto de fuerzas no conservativas (por ejemplo la fricción) no podemos hablar de energía potencial; sin embargo, la conservación de la energía se mantiene en la forma:
Em = Ec + Q donde Q es ahora el calor disipado al ambiente. En este caso la EC disminuyesiempre y eventualmente el calor transporta la energía a la atmósfera.Principios de la Conservación de la Energía Mecánica

Leer más: http://www.monografias.com/trabajos96/conservacion-energia/conservacion-energia.shtml#ixzz4cPOfw7ke





