BLOQUE TEMÁTICO:
|
|
|
TEMA:
|
Energía
|
|
SUBTEMAS:
|
11.- Calor como energía
|
|
LECCIÓN:
|
1.- Energía
térmica
|
|
APRENDIZAJES ESPERADOS:
|
• Analiza el calor como energía.
|

La energía térmica (también energía calórica o energía calorífica) es la manifestación de la energía en forma de calor. En todos los materiales los átomos que forman sus moléculas están en continuo movimiento ya sea trasladándose o vibrando. Este movimiento implica que los átomos tengan una determinada energía cinética a la que nosotros llamamos calor, energía térmica o energía calorífica. En cierto modo, la energía calorífica es la energía interna de un cuerpo.
Las moléculas además de desplazarse de un lado a otro dentro del cuerpo que integran, también pueden rotar o vibrar sin trasladarse. La energía térmica no tiene en cuenta las contribuciones que esas rotaciones o vibraciones aportan a la energía de las partículas. A la suma de la energía cinética, de rotación, vibración y cualquier tipo de energía que puedan tener todas las moléculas de un cuerpo se le llama ENERGÍA INTERNA.
La energía interna de un sistema termodinámico se puede cambiar de dos maneras: realizando un trabajo en el sistema y mediante el intercambio de calor con el medio ambiente. La energía que el cuerpo recibe o pierde en el proceso de intercambio de calor con el medio ambiente se denomina cantidad de calor o simplemente calor.
Transmisión de la energía térmica
La energía térmica puede transmitirse de un cuerpo a otro siguiendo las leyes de la termodinámica de tres modos distintos:
- Transmisión de calor por radiación.
- Transmision de energía térmica por conducción.
- Transmisión de energía calorífica por convección.
La energía térmica por radiación se transmite a través de ondas electromagnéticas. Es el modo con el que nos llega la energía térmica proveniente del Sol. El principal ejemplo de este caso lo encontramos en las instalaciones de energía solar térmica, que aprovechan la radiación solar para calentar agua. El agua caliente que se obtiene de estas instalaciones solares habitualmente se utiliza para calefacción y para usarla como agua caliente sanitária.
La transmisión de la energía térmica por conducción se experimenta cuando un cuerpo caliente está en contacto físico con otro cuerpo más frío. La energía se transmite siempre del cuerpo caliente al cuerpo frío. Si ambos cuerpos están a la misma temperatura no hay transferencia energética. Cuando tocamos un trozo de hielo con la mano parte de la energía térmica de nuestra mano se transfiere al hielo, por eso tenemos sensación de frío.

La transmisión de la energía térmica por convección se produce cuando se trasladan las moléculas calientes de un lado a otro. Seria el caso del viento, capaz de mover moléculas con cierta energía calorífica de un lado a otro.
Unidad de medida de la energía térmica
Las unidades para medir la energía térmica són las mismas unidades que se utilizan para medir energía puesto que no deja de ser una forma de energía.
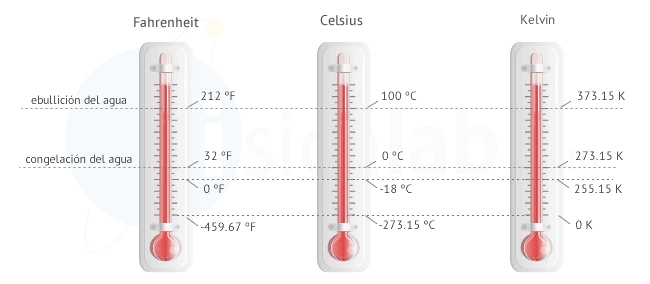
La energía se mide en Julios (J) según el sistema internacional. Aunque cuando se trata de energía calorífica también se suelen utilizar las calorías (cal). Una caloría es la cantidad de energía que se necesita para elevar un grado centígrado un gramo de agua. Una caloría equivale a 4.18 julios.
El calor en los cambios de fase
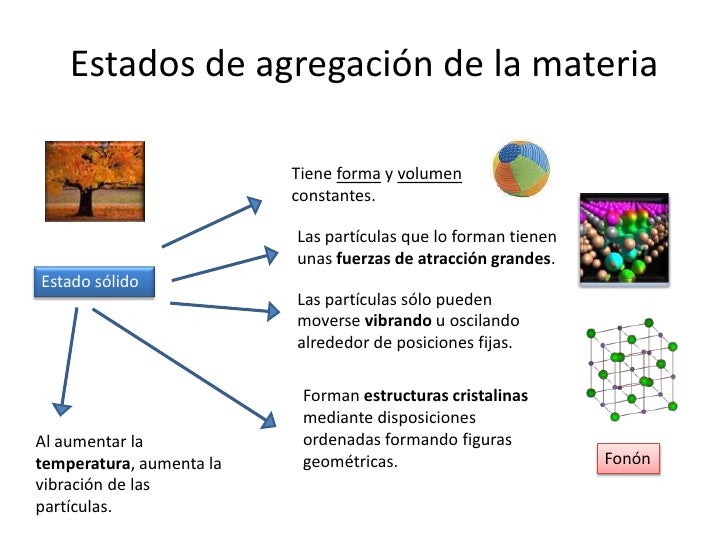
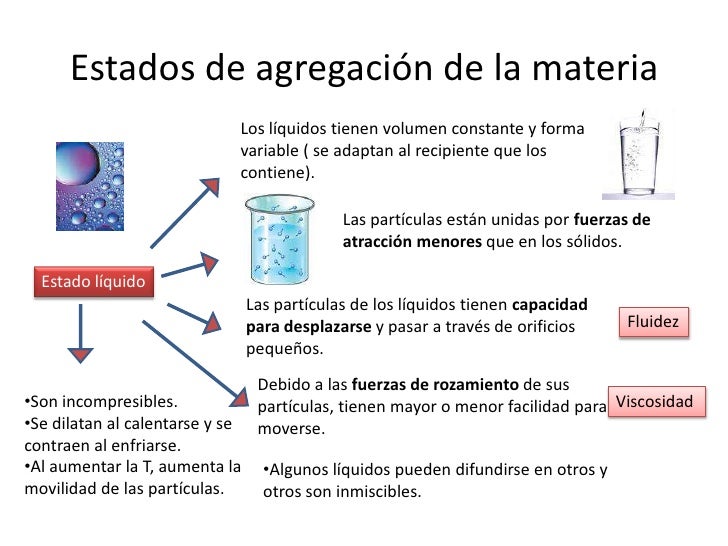
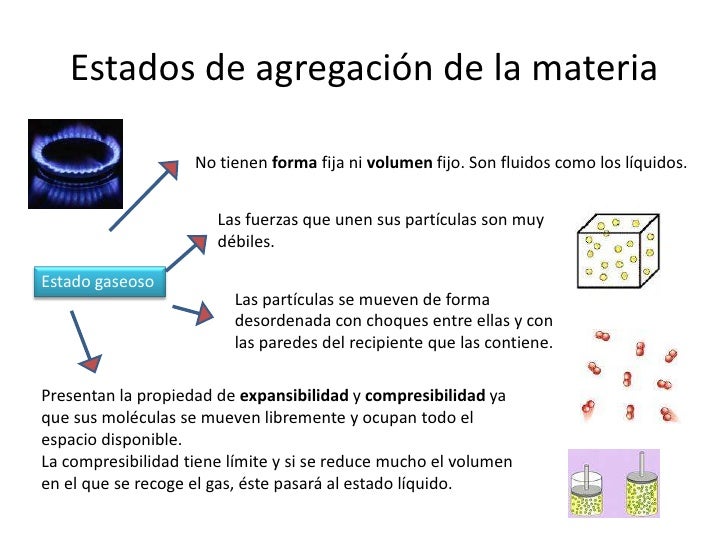
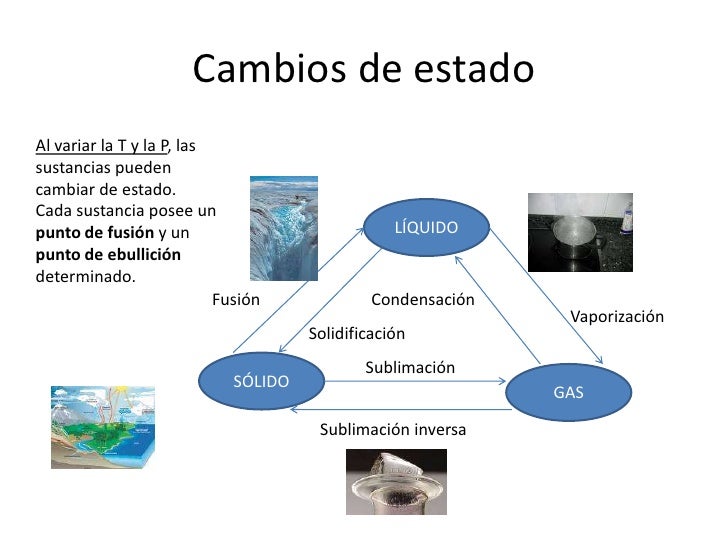
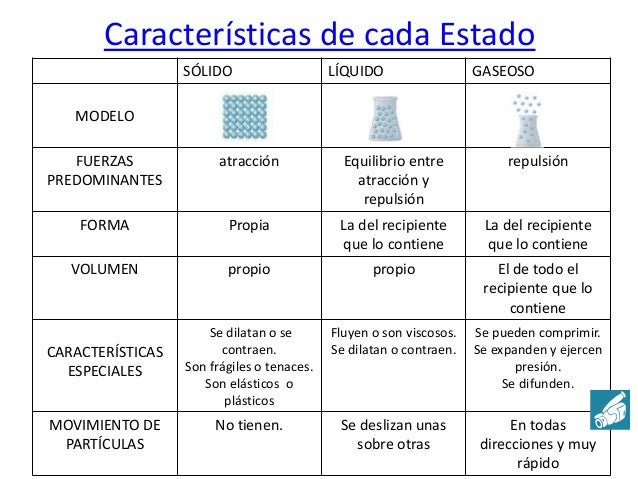
Si a un cuerpo se le suministra energía térmica aumente su temperatura. En cambio, si cede energía calorífica al exterior, se enfría. Esto sucede así siempre y cuando, este cuerpo no esté cambiando de fase. Es de decir, durante la transformación de sólido a líquido, de líquido a gas y viceversa la variación de calor no implica un cambio de temperatura hasta que la transformación esté completada.
Un ejemplo de este fenómeno lo podemos observar con el agua. Si al agua líquida se le suministra calor, esta aumenta la temperatura hasta llegar a los 100 grados Celsius, que entra en ebullición. A partir de esta temperatura todo el calor suministrado se utiliza para cambiar el estado líquido a gas (vapor de agua). En este momento la temperatura permanecerá constante hasta que toda el agua sea vapor. Cuando toda el agua es vapor, la temperatura puede seguir subiendo.
La energía requerida para la transición de fase de una unidad de masa de una sustancia se denomina calor específico de la transformación de fase. De acuerdo con el proceso físico que ocurre durante la transformación de fase, pueden liberar el calor de fusión, el calor de evaporación, el calor de sublimación (sublimación), el calor de recristalización, etc. Las transformaciones de fase ocurren con un cambio abrupto en la entropía, que se acompaña de la liberación o absorción de calor, a pesar de constancia de temperatura.
Te dejo este video para que lo construyas, si quieres ganarte 2 puntos en tu próximo examen. Es OPCIONAL.
Ve el video y contesta el cuestionario
TAREA PARA ENTREGAR EL VIERNES 3 DE ABRIL ANTES DE LAS 12:00 PM
1. Qué se la energía térmica?
2. Cómo fluye la energía térmica entre dos cuerpos?
3. LA energía térmica en qué otras formas de energía se puede transformar?
4. A qué se debe la presencia de E. térmica?
5. Cómo varía la E térmica con respecto a la temperatura?
6. Un objeto que esté quieto, posee E Térmica? Explica sí o no y por qué.
7. Qué es el calor?
8. Cuando pones a hervir agua y está a 100ºC y continuas calentando, hay aumento de temperatura?
Sí o no¿ Por qué? Explica
9. Menciona algunos ejemplos de E térmica.
10. La E Térmica se puede utilizar para generar electricidad? Explica.
11. Qué es una caloría?
12. En tu próxima comida calcula cuántas calorías ingieres en tus alimentos, investiga y de acuerdo a las porciones que ingieras, reporta las calorías ingeridas. Investiga también según tu edad y sexo, cuántas calorías debes ingerir al día. Pide ayuda de tus papás. Envías fotos de ellos ayudándote.
13. Te dejo el siguiente video para que lo construyas y me envíes fotos de tu horno solar. Es un trabajo en familia, pídele ayuda a tus papás para hacerlo. Coloca un chocolate y espera a que se derrita. Toma el tiempo en que lo hace y también su temperatura Es tarea. NO ES OPCIONAL.
14. QUÉ ES LA ENERGÍA INTERNA DE UN CUERPO?