BLOQUE TEMÁTICO:
|
Bloque II. Materia, energía e interacciones
|
TEMA:
|
Propiedades
|
SUBTEMAS:
|
8.- Los modelos en la ciencia
|
LECCIÓN:
|
1.- Explicación de los fenómenos de la naturaleza a partir de modelos
2.- Ideas en la historia en torno a la estructura de la materia. 3.- Aspectos básicos del modelo cinético de partículas |
APRENDIZAJES ESPERADOS:
|
• Describe las características del modelo de partículas y comprende su relevancia para representar la estructura de la materia.
|






IDEAS EN LA HISTORIA EN TORNO A LA ESTRUCTURA DE LA MATERIA










El 5 de octubre de 1906, el científico austríaco Ludwig Boltzmann (1844-1906) se ahorcó en una habitación en un hotel del pueblo llamado Duino, cerca de Trieste. Este acontecimiento trágico no habría tenido tanta trascendencia si no fuera por el hecho de que Boltzmann decidió quitarse la vida impulsado por la depresión profunda que sufrió al ver rechazada con desprecio, por la comunidad científica de entonces, su tesis sobre la realidad del átomo y por afirmar que toda la materia está compuesta por los mismos pequeños bloques.
Boltzmann había llegado a esta conclusión al estudiar el comportamiento de los gases. Su teoría era que éstos consisten en partículas que entrechocan entre sí en un movimiento caótico y que la energía de este movimiento es el calor.
Ludwig Boltzmann y muchos científicos imaginaron que si el vapor se componía de millones de diminutas esferas rígidas, era posible desarrollar algunas ecuaciones matemáticas que fueron capaces de predecir el comportamiento del vapor.
Boltzmann y sus colegas atomistas se vieron envueltos en una agria polémica con quienes negaban la existencia de átomos.
Estos últimos arguían que los invisibles átomos en los que se basaban los cálculos eran sólo una convención matemática, pero no objetos reales. Dijeron que era presuntuoso y blasfemo reducir el milagro de la creación a una serie de colisiones entre esferas diminutas inanimadas.
|  |
La afirmación de Boltzmann de que toda la materia está formada por átomos, era compartida por muchos científicos y químicos ilustres.
Entre ellos, el físico escocés James Clerk Maxwell (1831-1879), y el físico estadounidense Josiah Willard Gibbs (1831-1879).
La trágica ironía del suicidio de Boltzman es que, un año antes, en 1905, un joven científico había publicado un documento que de manera innegable e irrefutable proclamaba la realidad del átomo. Este joven era Albert Einstein.
Este informe que Einstein envió a la revista científica "Annalen del Physik" fue decisivo para zanjar la polémica.
| ||
Resulta muy ilustrativo recordar cómo llegó Albert Einstein al descubrimiento de los átomos.
Para ello, hay que remontarse al año 1827, cuando el ilustre botánico escocés, Robert Brown (1773-1858) roció unos granos de polen en un poco de agua y los examinó con un microscopio. Lo que observó fue algo realmente extraño. En lugar de granos flotando suavemente en el agua, vio que los granos se movían vertiginosamente como si tuvieran vida.
Este fenómeno, conocido desde entonces como movimiento browniano permaneció 80 años olvidado como una anomalía física que a nadie interesó mayormente.
En 1905, Einstein vio que el movimiento de los granos de polen podía resolver el debate acerca de la existencia de los átomos. Su argumentación era sencilla: si el agua estuviera compuesta por pequeñas partículas en movimiento, estarían golpeando continuamente a las partículas de polen.
Einstein fue más allá de los argumentos verbales y llevó a cabo un impecable estudio matemático con el que demostró no sólo que existían los átomos, sino que no se veían porque su tamaño era de una décima de millonésima de milímetro. El grosor de un fino cabello humano es un millón de veces más ancho que un átomo.
|

La teoría cinética molecular consta de cinco postulados que describen el comportamiento de las moléculas en un gas. Estos postulados se basan en algunas nociones físicas y químicas muy simples y básicas, aunque también involucran algunas suposiciones con el fin de simplificar los postulados.
Postulados de la teoría cinética molecular

Estos son los principales postulados de la teoría cinética molecular:
- Un gas consiste en un conjunto de pequeñas partículas que se trasladan con movimiento rectilíneo y obedecen las leyes de Newton.
- Las moléculas de un gas no ocupan volumen.
- Los choques entre las moléculas son perfectamente elásticos (esto quiere decir que no se gana ni se pierda energía durante el choque).
- No existen fuerzas de atracción ni de repulsión entre las moléculas.
- El promedio de energía cinética de una molécula es de 3kT/2 (siendo T la temperatura absoluta y k la constante de Boltzmann).
¿Qué significan estos postulados?
Según el modelo cinético molecular que se toma como válido hoy en día, como decíamos, todo material que vemos está formado por partículas muy pequeñas llamadas moléculas. Estas moléculas están en movimiento continuo y se encuentran unidas por la fuerza de cohesión que existe entre moléculas de una misma materia. Entre una y otra hay un espacio vacío, ya que están en continuo movimiento.
Cuando las moléculas están muy juntas y se mueven en una posición fija, las fuerzas de cohesión son muy grandes. Es el estado sólido de la materia. En cambio cuando están algo más separadas y la fuerza de cohesión es menor, lo que les permite cambiar de posición libremente de forma independiente, estamos en presencia de un líquido.
En el estado gaseoso, las moléculas están totalmente separadas unas de otras y se mueven libremente. Aquí no existe fuerza de cohesión.

La energía de la materia, su fuerza de cohesión y el movimiento de las moléculas dependen de la temperatura. Es por eso que podemos lograr pasar una materia del estado líquido al gaseoso y del sólido al líquido, si aplicamos la cantidad de energía necesaria en forma de temperatura.
Esta teoría también describe el comportamiento y las propiedades de los gases. Todos los gases están formados por moléculas que se encuentran en movimiento continuo. Es un movimiento rápido, rectilíneo y aleatorio. Las moléculas de los gases están muy separadas entre sí y no ejercen fuerzas sobre otras moléculas, a excepción de cuando se produce una colisión.
Las propiedades de los gases se describen en términos de presión, volumen, temperatura y número de moléculas. Estos son los parámetros que se usan para definir a los gases.
Modelo cinético de partículas
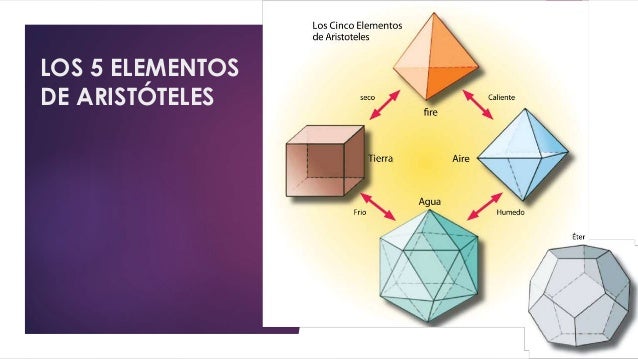
14052012 Para entender cómo está formada la materia, tuvieron que pasar más de 20 siglos y esa pregunta no está resuelta del todo. En un principio existieron dos teorías. Una de ellas proponía a la materia como divisible hasta el infinito y que cada de una de las partes conservaba las características de la totalidad de la cual surgió. La otra teoría propone que la división infinita de la materia es posible hasta cierto punto y que existe una cantidad mínima de la cual parte todo. A este modelo se le llamó modelo discontinuo de la materia. Y es ahí, en la misma Grecia, que surge la idea de una partícula básica, mínima, indivisible y en constante movimiento denominada átomo. Y aunque esta idea nació hace tantísimo tiempo, no fue retomada sino más de 2000 años. Cuando se empiezan a estudiar con más detalle el estado gaseoso, los científicos son capaces de explicar el comportamiento de los gases imaginando que están formados por partículas y espacio vacío, de esta manera es posible comprender propiedades como la expansión y la compresión. Así es como surgió el modelo cinético de partículas, que más tarde se adapta a los demás estados de la materia con muy buenos resultados. Bajo esta perspectiva, debemos considerar que en la época de Newton, por ejemplo, átomo y partícula eran tratados como sinónimos, la realidad es que no lo son. En la actualidad se concibe una partícula como porción mínima de materia que conserva las características y propiedades de la totalidad de la materia que forma parte. A partir de estos estudios nace un modelo basado en la existencia de las partículas, el cual es llamado “modelo cinético de partículas”, entre sus postulados básicos están los siguientes:
Para entender cómo está formada la materia, tuvieron que pasar más de 20 siglos y esa pregunta no está resuelta del todo. En un principio existieron dos teorías. Una de ellas proponía a la materia como divisible hasta el infinito y que cada de una de las partes conservaba las características de la totalidad de la cual surgió. La otra teoría propone que la división infinita de la materia es posible hasta cierto punto y que existe una cantidad mínima de la cual parte todo. A este modelo se le llamó modelo discontinuo de la materia. Y es ahí, en la misma Grecia, que surge la idea de una partícula básica, mínima, indivisible y en constante movimiento denominada átomo. Y aunque esta idea nació hace tantísimo tiempo, no fue retomada sino más de 2000 años. Cuando se empiezan a estudiar con más detalle el estado gaseoso, los científicos son capaces de explicar el comportamiento de los gases imaginando que están formados por partículas y espacio vacío, de esta manera es posible comprender propiedades como la expansión y la compresión. Así es como surgió el modelo cinético de partículas, que más tarde se adapta a los demás estados de la materia con muy buenos resultados. Bajo esta perspectiva, debemos considerar que en la época de Newton, por ejemplo, átomo y partícula eran tratados como sinónimos, la realidad es que no lo son. En la actualidad se concibe una partícula como porción mínima de materia que conserva las características y propiedades de la totalidad de la materia que forma parte. A partir de estos estudios nace un modelo basado en la existencia de las partículas, el cual es llamado “modelo cinético de partículas”, entre sus postulados básicos están los siguientes:Toda la materia está formada por partículas.
Las partículas se encuentran siempre en movimiento.
Las partículas interaccionan entre sí con fuerzas de mayor o menor intensidad
La distancia que existe entre partícula y partícula es muy grande en comparación con su tamaño
Los choques entre partícula-partícula y entre la partícula y la pared del recipiente en donde se encuentran ocurren sin pérdida de energía.
La energía cinética promedio de las partículas es proporcional a su temperatura.