BLOQUE TEMÁTICO:
|
Bloque IV. Manifestaciones de la estructura
interna de la materia
|
TEMA:
|
Explicación de los fenómenos eléctricos: el modelo atómico
|
SUBTEMAS:
|
• Características básicas del modelo atómico: núcleo con protones y
neutrones, y electrones en órbitas. Carga eléctrica del electrón.
|
APRENDIZAJES ESPERADOS
|
• Relaciona la búsqueda de mejores explicaciones y el avance de la
ciencia, a partir del desarrollo histórico del modelo atómico.
|

1- ¿Qué es un átomo?
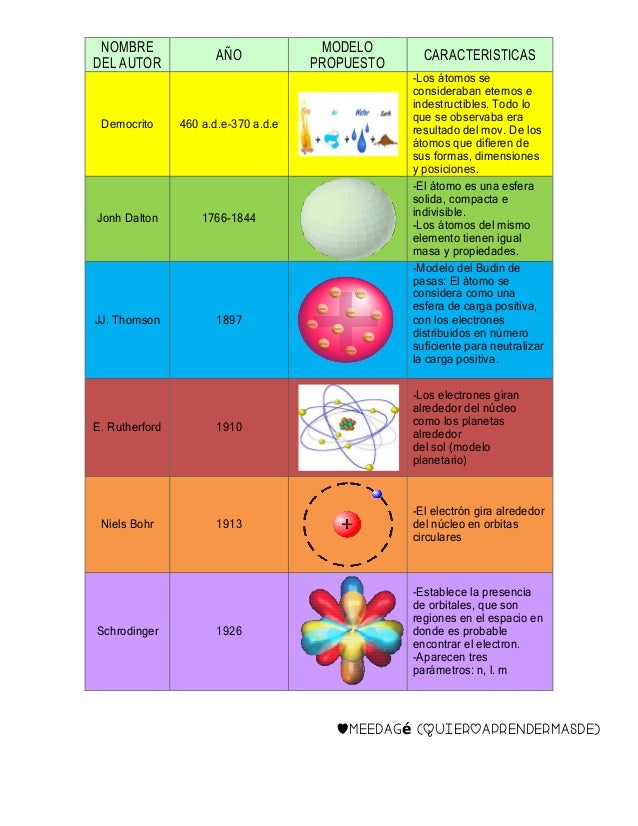
Definimos átomo como la partícula más pequeña en que un elemento puede ser dividido sin perder sus propiedades químicas. Aunque el origen de la palabra átomo proviene del griego, que significa indivisible, los átomos están formados por partículas aún más pequeñas, las partículas subatómicas.
Generalmente, estas partículas subatómicas con las que están formados los átomos son tres: los electrones, los protones y los neutrones. Lo que diferencia a un átomo de otro es la relación que se establecen entre ellas.

Los protones y neutrones se encuentran agrupados en el centro del átomo formando el núcleo atómico del átomo. Por este motivo también se les llama nucleones. Los electrones aparecen orbitando alrededor del núcleo del átomo.
De este modo, la parte central del átomo, el núcleo atómico, tiene una carga positiva en la que se concentra casi toda su masa, mientras que en el escorzo, alrededor del núcleo atómico, hay un cierto número de electrones, cargados negativamente. La carga total del núcleo atómico (positiva) es igual a la carga negativa de los electrones, de modo que la carga eléctrica total del átomo sea neutra.
Esta descripción de los electrones orbitando alrededor del núcleo atómico corresponde al sencillo modelo de Bohr. Según la mecánica cuántica cada partícula tiene una función de onda que ocupa todo el espacio y los electrones no se encuentran localizados en órbitas aunque la probabilidad de presencia sea más alta a una cierta distancia del núcleo.
2- Propiedades de los átomos
Las unidades básicas de la química son los átomos. Durante las reacciones químicas los átomos se conservan como tales, no se crean ni se destruyen, pero se organizan de manera diferente creando enlaces diferentes entre un átomo y otro.
Los átomos se agrupan formando moléculas y otros tipos de materiales. Cada tipo de molécula es la combinación de un cierto número de átomos enlazados entre ellos de una manera específica.
Según la composición de cada átomo se diferencian los distintos elementos químicos representados en la tabla periódica de los elementos químicos. En esta tabla podemos encontrar el número atómico y el número másico de cada elemento:
- Número atómico, se representa con la letra Z, indica la cantidad de protones que presenta un átomo, que es igual a la de electrones. Todos los átomos con un mismo número de protones pertenecen al mismo elemento y tienen las mismas propiedades químicas. Por ejemplo todos los átomos con un protón serán de hidrógeno (Z = 1), todos los átomos con dos protones serán de helio (Z = 2).
- Número másico, se representa con la letra A, y hace referencia a la suma de protones y neutrones que contiene el elemento. Los isótopos son dos átomos con el mismo número de protones, pero diferente número de neutrones. Los isótopos de un mismo elemento, tienen unas propiedades químicas y físicas muy parecidas entre sí.
A = p+ + n°
A = Z + n°

Historia de la ciencia: el descubrimiento del electrón
El 30 de abril de 1897, Joseph John (JJ) Thomson (1856-1940) anunció el descubrimiento del electrón (aunque él no lo llamó así, lo llamó corpúsculo) en una conferencia impartida en la Royal Institution (Londres). Los resultados se publicaron en la revista Philosophical Magazine, 44, 293 (1897).
En la imagen se puede ver la primera página de la reseña que la revista Electrician dedicó al anuncio del descubrimiento.
Thomson investigaba el efecto de las descargas electrícas sobre gases a presión reducida, usando tubos de descargas como el de Crookes (1832-1919) o el de Hittorf (1824-1914). Estaba especialmente interesado en el estudio de los rayos catódicos, un término acuñado por Goldstein (1850-1930). Era un tema en el que muchos investigadores estaban interesados. Thomson probó que los rayos catódicos tenían naturaleza corpuescular, estando formados por electrones.
El electrón era una partícula más ligera que cualquier elemento conocido y constituyente de todos los átomos; lo que demostraba que estos no eran indivisibles. Este descubrimiento supuso uno de los hitos de la revolución de la ciencia de finales del siglo XIX que desembocó en una nueva concepción de la estructura de la materia y su interacción con la energía.
La existencia del electrón había sido predicha por numerosos investigadores y fue propuesta como al unidad de carga en electroquímica por G. Johnstone Stoney (1826-1911), que también propuso el nombre “electrón” en 1881.
Thomson hizo el descubrimiento en el Laboratorio Cavendish de la Universidad de Cambridge, del que era director; y donde, junto a Ernest Rutherford (1871-1937), creó una gran escuela de física experimental. Thomson recibió el Premio Nobel de Física en 1906 por el descubrimiento del electrón. Curiosamente, su hijo George Pagget Thomson (1892-1975) también fue galardonado con el Premio Nobel (Física, 1937) por demostrar que el electrón es una onda; constituyendo la demostración experimental de la dualidad onda-corpúsculo de las partículas elementales.
El descubrimiento del Protón
Generalmente es a Ernest Rutherford a quien se le acredita el descubrimiento del protón.
En el año 1918 Rutherford descubrió que cuando se disparan partículas alfa contra un gas de nitrógeno, sus detectores de centelleo muestran los signos de núcleos de hidrógeno. Rutherford determinó que el único sitio del cual podían provenir estos núcleos era del nitrógeno y que por tanto el nitrógeno debía contener núcleos de hidrógeno.
Por estas razones Rutherford sugirió que el núcleo de hidrógeno, que en la época se sabía que su número atómico era 1, debía ser una partícula fundamental.
Por estas razones Rutherford sugirió que el núcleo de hidrógeno, que en la época se sabía que su número atómico era 1, debía ser una partícula fundamental.

Antes que Rutherford,
Eugen Goldstein había observado rayos catódicos compuestos de iones cargados positivamente en 1886. Luego del descubrimiento del electrón por J.J. Thomson, Goldstein sugirió que puesto que el átomo era eléctricamente neutro, el mismo debía contener partículas cargadas positivamente.
Eugen Goldstein había observado rayos catódicos compuestos de iones cargados positivamente en 1886. Luego del descubrimiento del electrón por J.J. Thomson, Goldstein sugirió que puesto que el átomo era eléctricamente neutro, el mismo debía contener partículas cargadas positivamente.
Goldstein usó los rayos canales y pudo calcular la razón carga/masa.
Realizó algunos experimentos con un tubo de rayos catódicos con el cátodo perforado. Observó unos rayos que atravesaban al cátodo en sentido contrario a los rayos catódicos. Recibieron el nombre de rayos canales.
El estudio de estos rayos determinó que estaban formados por partículas de carga positiva y que tenían una masa distinta según cual fuera el gas que estaba encerrado en el tubo. Esto aclaró que las partículas salían del seno del gas y no del electrodo positivo.

Al experimentar con hidrógeno se consiguió aislar la partícula elemental positiva o protón, cuya carga es la misma que la del electrón pero positiva y su masa es 1837 veces mayor.
- Los protones tienen carga positiva.
Encontró que dichas razones cambiaban cuando variaban los gases que usaba en el tubo de rayos catódicos. Lo que Goldstein creía que eran protones resultaron ser iones positivos. Sin embargo, sus trabajos fueron largamente ignorados por la comunidad de físicos.
Carga eléctrica y masa relativa
de los protones, neutrones y electrones
|
|||||
Partícula
|
Símbolo
|
Masa
gramos
|
Masa Relativa (uma)
|
Carga Relativa
|
Localización Atómica
|
protón
|
p+
|
1.673x10-24
|
1
|
1+
|
núcleo
|
neutrón
|
no
|
1.675x10-24
|
1
|
0
|
núcleo
|
electrón
|
e-
|
9.11x10-28
|
despreciable
|
1-
|
afuera/alrededor
del núcleo (orbitales/niveles de energía)
|



No hay comentarios:
Publicar un comentario