BLOQUE TEMÁTICO:
|
Bloque III. Un modelo para describir la
estructura de la materia
|
TEMA:
|
Los modelos en la ciencia
|
SUBTEMAS:
|
• Aspectos básicos del modelo
cinético de partículas: partículas microscópicas indivisibles, con masa,
movimiento, interacciones y vacío entre ellas.
|
APRENDIZAJES ESPERADOS
|
• Describe los aspectos básicos que conforman el modelo cinético de
partículas y explica el efecto de la velocidad de éstas
|
Conoce:
Realiza los 2 experimentos siguientes y preséntalos en clase
TCM, la teoría cinética de la materia
La idea de que la materia es discontinua, es decir, que está formada por partículas muy pequeñas, átomos y moléculas, ya apareció en la Grecia Clásica en el siglo V a.C. Dos filósofos griegos, Leucipo y Demócrito, ya aventuraron la existencia de átomos, aunque sus “observaciones” (1) carecían del rigor que el método científico impone.
Mucho más tarde, en 1803, el químico británico John Dalton utilizó la existencia de átomos para la explicación de las leyes de la Química. De la teoría atómica de Dalton se pudo desprender una primitiva idea de molécula, como resultado de la combinación de dos o más tipos de átomos (2). Aunque con algunas alteraciones producto de las observaciones, la teoría atómica sobrevivió al convulso, científicamente hablando, siglo XIX y en ella se apoyaron los físicos L. E. Botlzmann y J. C. Maxwell (de forma independiente) para construir una teoría cinético-molecular de la materia (3). Este modelo, se basaba en las siguientes suposiciones:
- La materia está formada por un conjunto de átomos y moléculas en continuo movimiento
- El tamaño de las partículas es despreciable frente a la distancia que las separa entre sí
- Las partículas chocan entre sí, y con otras superficies, de manera elástica.

La primera parte del punto i es bastante sencilla de comprender porque hay acumulada sobrada evidencia empírica acerca de la existencia de los átomos y de las moléculas. Sin embargo, admitir que estas partículas no dejan de moverse supone un paso más allá. De hecho, el grado de movimiento en un material es lo que distingue, desde el punto de vista macroscópico, los estados de la materia más habituales: sólido, líquido y gaseoso.
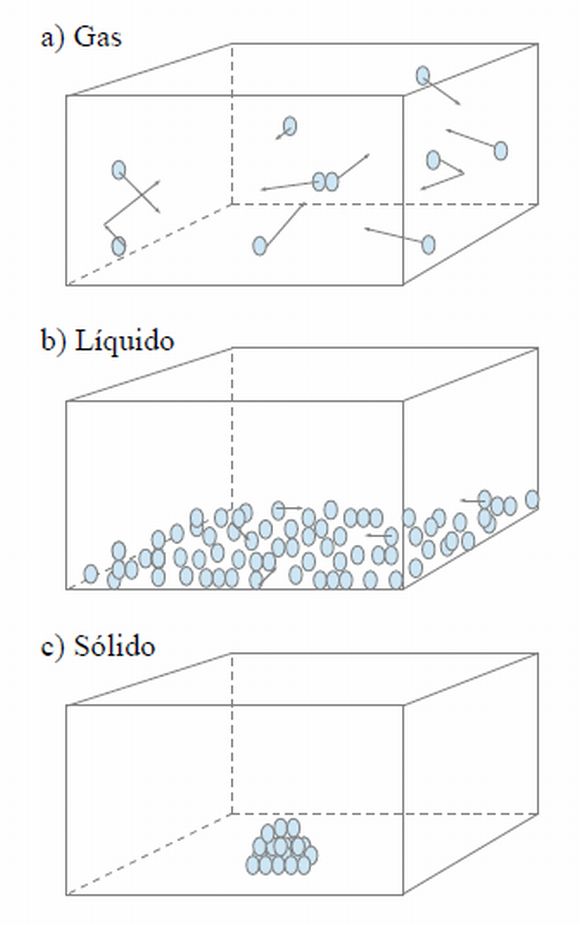
Así, para la teoría cinética de la materia, en un gas hay muchísima separación entre sus moléculas y, por tanto, éstas tienen una gran libertad para moverse, tal y como puede apreciarse en la Figura 2a). De cuando en cuando y producto del movimiento constante, surgen colisiones entre moléculas o entre las paredes y alguna molécula, lo que origina la magnitud que conocemos como presión. Para que lo entendamos, el estado gaseoso es como una habitación con las personas muy separadas unas de otras, de modo que tienen casi total libertad para moverse continuamente (Figura 2b).
En el estado líquido, las partículas están bastante más próximas entre sí, lo que explica algunas de sus propiedades (volumen fijo, se adaptan a la forma del recipiente, …) y en los sólidos, las partículas están muchísimo más próximas. Desde el punto de vista microscópico, por tanto, el estado gaseoso es el más simple de todos, ya que las partículas están muy lejanas unas de otras, lo que disminuye la frecuencia de los choques. En los estados sólido y líquido la cosa se complica porque aparecen las fuerzas de cohesión, las fuerzas necesarias para explicar por qué las partículas están tan próximas unas de otras. De hecho, los grandes avances de la teoría cinética se produjeron en el campo de los gases, ya que se conocía muy bien el estado gaseoso (4), gracias a los trabajos experimentales de Robert Boyle, Jacques Charles o de Luis Joseph Gay-Lussac.
Las conclusiones más importantes de estos científicos brillantes fueron:
1) Los gases ocupan todo el volumen disponible y no tienen una forma fija.
2) Los gases se pueden comprimir con mucha más facilidad que los sólidos o los líquidos
3) El volumen, a una presión dada ocupado por un gas es directamente proporcional a su temperatura. Es decir, a mayor temperatura, mayor volumen si la presión es constante.
4) La presión que ejerce un gas, a un volumen dado, es también directamente proporcional a la temperatura; a mayor temperatura, mayor presión si el volumen se mantiene constante.
5) La presión y el volumen son inversamente proporcionales. Esto quiere decir que a una misma temperatura, cuanto mayor es la presión, menor es el volumen.
Estos hechos empíricos son fácilmente entendibles con la ayuda de un globo inflado con aire.
Para que el aire no se escape del globo, debemos atar uno de sus extremos (propiedad 1), por la tendencia del gas a ocupar todo el volumen disponible. Sobre un globo de aire es relativamente fácil ejercer fuerzas de compresión (2) y todo el mundo sabe que al exponer a la luz solar durante mucho tiempo un globo inflado, la temperatura aumenta y el volumen del globo también (3), lo que hace que aumente la presión del gas dentro de él en virtud de la conclusión (4). La propiedad 5 es también muy intuituva: si apretamos el globo (esto es, lo presionamos), el tamaño del globo disminuye y, por tanto, se reduce su volumen (5).
Todas estas propiedades se resumen en la llamada ecuación del gas ideal en la que p es la presión; V, el volumen del gas; n es la cantidad de gas; R es un valor contante, y T es la temperatura. Esta ecuación es fácil de leer: el producto de la presión y el volumen debe ser numéricamente igual al resultado de la multiplicación de la cantidad de gas por la constante R y por la temperatura.

Podemos eliminar el número de moléculas, N, ya que se encuentra a izquierda y derecha de la ecuación:
Cuanto mayor es la temperatura, mayor es la velocidad de las partículas, lo que explicaría los puntos 3 y 4 del comportamiento de los gases. Si se aumenta la temperatura, también lo hace la velocidad media de las partículas con lo que, para mantener constante la presión, es necesario que aumente el volumen del gas. Por el otro lado, aumentar la temperatura manteniendo constante el volumen, supone una mayor velocidad media de las moléculas, lo que se traduce en más colisiones y, por tanto, en mayor presión.
Para comprenderlo bien, sigamos con la analogía de la habitación con personas (Figura 2b).
Si los individuos de la Figura 2b comienzan a ir más deprisa (aumenta la velocidad v), las colisiones serán más probables y el ambiente se hace más tenso – mayor presión – y más cargado – mayor temperatura.
. Si partimos de una sustancia gaseosa (Figura 3a) y comenzamos a enfriarla, la temperatura bajará hasta que se convierta en estado líquido. El estado líquido es, por tanto, mucho más cohesionado que el gaseoso, ya que las partículas se mueven con mucha menos velocidad y están más próximas entre sí, tal y como podemos observar en la Figura 3b.
No obstante, en el estado líquido las moléculas siguen moviéndose. Si continuamos enfriando, en virtud de la ecuación (6), la velocidad de las moléculas seguirá disminuyendo y las partículas acabarán ocupando posiciones más o menos fijas y vibrando en torno a ellas. Tan sólo en el cero absoluto ( – 273,15 ºC ) las moléculas dejarían de moverse por completo.
El gran éxito de la teoría cinética, como hemos visto, radica en su capacidad para relacionar el mundo microscópico (moléculas y átomos) con propiedades observables (estado físico, presión, temperatura, …) utilizando un andamiaje matemático sencillo. De hecho, es capaz de calcular algunas propiedades con relativo éxito (conductividad térmica, viscosidad, coeficiente de difusión, …) o de explicar la composición gaseosa de nuestra atmósfera. La gran limitación de este modelo es que se complica enormemente cuando se consideran las fuerzas atractivas que hacen que ni siquiera la ecuación del gas ideal sea válida (7). Pero ése es otro tema que daría para otro artículo
MODELO CINÉTICO - MOLECULAR DE LA MATERIA1
Para explicar el
comportamiento de la materia y las características de los gases, los
científicos propusieron, durante el siglo XIX, la denominada "Teoría cinética de los gases". Su ampliación a líquidos y sólidos dio
lugar al Modelo cinético - molecular de
la materia.
Este modelo se basa en
dos postulados fundamentales.
-
La
materia es discontinua, es decir, está formada por un gran número de partículas separadas entre sí.
-
Estas partículas materiales se encuentran en
constante movimiento debido a dos clases de fuerzas: de cohesión y de repulsión.
Las
fuerzas de cohesión tienden a mantener las partículas materiales unidas entre
sí.
Las
fuerzas de repulsión tienden a dispersar las partículas y a alejarlas unas de
otras.
Según
que predominen unas u otras fuerzas, la materia se presenta en estado sólido,
líquido o gaseoso.
Estado sólido
|
Estado
líquido
|
Estado
gaseoso
|
|||||
Las
fuerzas de
|
Predominan
las fuerzas
|
||||||
cohesión
y de repulsión
|
de
repulsión sobre las
|
||||||
Predominan las fuerzas
|
son
del mismo orden.
|
de
cohesión.
|
|||||
Las partículas pueden
|
Las partículas se mueven
|
||||||
de cohesión sobre las
|
|||||||
desplazarse con cierta
|
con total libertad y
|
||||||
de repulsión.
|
|||||||
libertad pero sin
|
están muy alejadas
unas
|
||||||
Las partículas sólo
|
|||||||
alejarse unas de otras.
|
de otras. Por eso los
|
||||||
pueden vibrar
alrededor
|
|||||||
Por esa razón los
|
gases tienen forma
|
||||||
de su posición de
|
|||||||
variable y tienden a
|
|||||||
líquidos tienen
volumen
|
|||||||
equilibrio.
|
|||||||
ocupar todo el volumen
|
|||||||
constante y se adaptan a
|
|||||||
disponible.
|
|||||||
la forma del recipiente.
|
|||||||
TAREA PARA ENTREGAR EL VIERNES 15 MARZO
Realiza las 2 actividades que vienen al final del video
Además, Contesta las siguientes preguntas
1. Justifica, a partir de la TCM, por qué los gases:
a) Son fácilmente compresibles.
b) Son menos densos que los líquidos.
c) Ocupan todo el volumen del recipiente.
2 Explica, a partir de la TCM, los estados de agregación de la materia.

No hay comentarios:
Publicar un comentario