| |||||||||||||||||||||||||||
lunes, 26 de febrero de 2018
Semana del 26 de Febrero al 2 Marzo 2018
• Temperatura y sus escalas de medición.
domingo, 18 de febrero de 2018
Semana del 19 al 23 Febrero 2018
GUÍA ESTUDIO EXAMEN FEBRERO
¿Qué es el movimiento browniano en los gases?
¿Qué es un choque elástico entre las partículas de un gas?
Coloca en el paréntesis la letra que corresponde a la
respuesta correcta.
( ) ¿Cuál es la unidad de medida de la
masa?
a)
decímetro
b)
centímetro
c)
kilogramo
d)
metro cuadrado
( ) ¿Cuál es una característica de los
líquidos?
a)
Pueden comprimirse con
mucha facilidad
b)
Se adaptan al
recipiente que los contiene
c)
Tienen distancias
intermoleculares muy pequeñas
d)
Ocupan la totalidad
del recipiente que los contiene
( ) ¿Cuál es el principio de Arquímedes?
a)
Si se realiza trabajo
sobre un sistema, la energía interna del sistema variará
b) Existe una fuerza que empuja
de abajo hacia arriba a los cuerpos que se sumergen en un liquido
c)
Relación entre los
cambios en la energía cinética, la energía potencial y la presión de un fluido
en el que no hay disipación
d)
La presión aplicada en
un punto del fluido estático e incompresible encerrado en un recipiente, se
transmite íntegramente a todos los
puntos del fluido
( ) ¿Cuál es la densidad de un cubo que
tiene 1.5 m3 y pesa 15 kg?
a)
10 kg/m3
b)
25 kg/m3
c)
30 kg/m3
d)
40kg/m3
Relaciona las columnas.
|
(
) 5 Medición que resulta de dividir la cantidad de materia entre el
volumen que ocupa.
(
) 6 Atrae a los átomos, y hace que se junten y mantengan así,
formando compuesto y moléculas.
(
) 7 Tiene gran fuerza de cohesión, puede ser elástico, duro o frágil.
( ) 8 Su fuerza de cohesión es débil y le
permite deslizar unas moléculas sobre otras.
(
) 9 Cantidad de espacio ocupado por un cuerpo.
(
) 10 Es altamente compresible y tiene una fuerza de cohesión nula.
(
) 11 Cantidad de materia que posee un cuerpo
|
1 Masa
2 Fuerza de cohesión
3 Densidad
4 volumen
5 Sólido
6 Líquido
7
Gaseoso
|
Completa los siguientes
párrafos con las palabras que aparecen abajo.
Las
moléculas o átomos de un sólido tienen distancias intermoleculares
__________________ que contribuyen a que la fuerza de __________________ entre ellas sea grande, lo
cual da a que los sólidos tengan _____________________ y _________________
propios. Los líquidos no se pueden deformar debido a la propiedad de _____________________, esta propiedad se aplica en la construcción de la _______________________
Volumen prensa hidráulica pequeñas cohesión repulsión forma compresibilidad
IV.- Responde las siguientes
preguntas.
¿Qué es presión?
¿Qué es densidad?
sábado, 10 de febrero de 2018
Semana del 12 al 16 Febrero 2018
2.1. Principio de Pascal
Principio de Pascal
La presión aplicada sobre un fluido confinado en un recipiente, se transmite íntegramente en todas las direcciones y ejerce fuerzas iguales sobre áreas iguales, actuando estas fuerzas perpendicularmente sobre las paredes del recipiente contenedor.
En la imagen inferior puedes ver un ejemplo práctico del Principio de Pascal. Al ejercer una presión con un pistón sobre un fluido confinado en un depósito esférico, esta presión se transmite idénticamente en cada uno de los puntos de las paredes del contenedor.
 |
| Imagen 6. Blogspot. Creative Commons |
En el siguiente video puedes ver varios experimentos que ponen de manifiesto el principio de Pascal.(1'36'')
El principio de Pascal es la base en la que se apoya el funcionamiento de las máquinas hidráulicas: la prensa, el freno, la grúa, el ascensor, el gato,...
La prensa hidráulica, permite prensar, levantar pesos o estampar metales ejerciendo pequeñas fuerzas. Veamos como funciona:
 |
| Imagen 7. Blogspot. Creative Commons |
La figura representa una prensa hidráulica en la que un fluido llena un circuito, que consta de dos cuellos de diferente sección cerrados con sendos émbolos (pistones) ajustados, capaces de desplazarse dentro de los tubos (cilindros). Si se ejerce una fuerza (F1) sobre el pistón pequeño (A1), la presión ejercida se transmite a todos los puntos del fluido dentro del recinto y produce fuerzas perpendiculares a las paredes.
En particular, la porción de pared representada por el pistón grande (A2) recibe una fuerza (F2) de forma que mientras el pistón pequeño baja, el pistón grande sube. La presión sobre los pistones es la misma:

Sin embargo las fuerzas no lo van a ser, para ello tengamos en cuenta que la presión se obtiene dividiendo la fuerza por la superficie. Por lo tanto:

Por lo que si la superficie del pistón grande es diez veces mayor que la del pequeño, entonces el módulo de la fuerza obtenida será diez veces mayor que la ejercida sobre el pistón pequeño. Dicho de otra forma para levantar el vehículo habrá que aplicar una fuerza diez veces menor utilizando esta prensa hidráulica que si lo quisieramos lenvantar directamente.
Esta máquina reduce la fuerza necesaria, pero no te confundas, no multiplica la energía. El volumen de líquido desplazado por el pistón pequeño se distribuye en una capa delgada en el pistón grande, de modo que el producto de la fuerza por el desplazamiento (el trabajo) es igual en ambos pistones. Lo entenderás mejor viendo la siguiente imagen.
 |
| Imagen 8. Blospot. Creative Commons |
En este caso la fuerza se aplica sobre el pistón pequeño a través de una palanca. El mecánico tiene que hacer poca fuerza para mover el mecanismo, sin embargo tendrá que ejercerlo muchas veces para poder conseguir desplazar todo el volumen de líquido necesario.
Otra aplicación del principio de Pascal son los sistemas de frenado:
Los frenos de un automóvil son un conjunto de mecanismos que permiten reducir la velocidad y parar el vehículo mientras se conduce.
| Imagen 9. automotriz. Copyright |
Casi todos los vehículos usan este tipo de sistema, que utiliza presión hidráulica para hacer funcionar los frenos en cada una de las ruedas, Tanto da que sean frenos de tambor, prácticamente en desuso, o frenos de disco, que son los que actualmente montan casi todos los automóviles. El principio de funcionamiento es similar al de la prensa hidráulica.
A continuación te dejo dos videos para que te muestren cómo hacer tu prensa hidraúlica y presentarla para ganarte participaciones.
Mano Hidráulica

lunes, 5 de febrero de 2018
Semana del 6 al 9 Febrero 2018
La estructura de la materia a partir del modelo cinético de
partículas
• Las propiedades de la materia: masa, volumen, densidad y estados de agregación.

Te dejo el siguiente video para que hagas tu torre de líquidos y lo presentes en clase para que te ganes participaciones. Hazlo!!!!!
Construye tu lámpara de lava y preséntala en clase
También te dejo el siguiente video para que construyas esta lámpara con luz de neón si no te gustó la anterior. Suerte!!!!
• Las propiedades de la materia: masa, volumen, densidad y estados de agregación.
La estructura de la materia a partir del modelo cinético de partículas.
Las propiedades de la materia: masa, volumen, densidad y estados de agregación.
Todas las sustancias que nos rodean están constituidas por materia, que tiene masa y ocupa volumen. Una propiedad de la materia es alguna de sus características, atributos o cualidades esenciales.
El tamaño o el peso nos ofrecen el primer indicio de la materia por medio del cual podemos describirla. Estas propiedades dependen de la cantidad de materia, por tanto las llamamos propiedades extensivas.
El color, por ejemplo, es otra propiedad. A partir de ella podemos clasificar la materia como roja, verde, azul o incolora. Sin embargo el color de la materia no depende de la cantidad que tengamos. Aquellas propiedades que no dependen del tamaño de la muestra de materia se conocen comopropiedades intensivas.
La densidad es una propiedad intensiva, se refiere a la cantidad de masa contenida en un determinado volumen de una sustancia.
Otra propiedad intensiva importante es el estado de agregación. Es la condición o manifestación por las que se encuentran los estados de la materia, por influencia de la presión y la temperatura; es decir, si la materia es sólida, líquida o gaseosa.
Modelo cinético de partículas: indica que todas las partículas tienen energía cinética (la que es mayor en gases y menor en sólidos) y que toda la materia está formada por partículas discretas llamadas moléculas.
Muchas de las propiedades de la materia se pueden interpretar con este modelo, como se muestra a continuación:
Sólido
| |
Hechos
|
Modelo
|
-Tiene forma definida y volumen fijo.
-Muchos de ellos se presentan en forma de cristales.
-Su densidad es, en general, mayor que la de los líquidos y la de los gases, por lo que muchos de ellos se hunden en el agua.
-Se deforman sólo bajo la acción de fuerzas extremas. No fluyen, ni se mezclan entre sí.
|
Las partículas que lo forman se encuentran muy cercanas y están ordenadas en forma de una red tridimensional. La interacción entre ellas es fuerte y, por tanto, no se pueden mover a gran velocidad hacia otros sitios. Las partículas tienen poca energía cinética.
Las partículas tienen poca energía cinética.
|
Líquidos
| |
Hechos
|
Modelo
|
-Toman la forma del recipiente que los contiene.
-Tiene volumen fijo.
Su densidad es, en general, mayor que la de los gases y menor que la de los sólidos.
-Se pueden deformar.
-Se pueden mezclar.
|
La interacción entre las partículas es menor, por lo que su movilidad es mayor, lo que permite tomar la forma del recipiente que los contiene. Las moléculas de un líquido toman posición al azar y que cambian de un momento al siguiente. Aún así, la distancia entre las moléculas varía sólo dentro de un estrecho margen.
La energía cinética de las partículas es mayor que cuando están en estado sólido.
|
Gases
| |
Hechos
|
Modelo
|
-Su forma y volumen son variables, ocupan todo el recipiente en el que se encuentra.
-Si el volumen del recipiente se reduce, el volumen de la materia en estado gaseoso también disminuye.
-Tiene baja densidad.
–Se puede deformar.
–Se mezclan fácilmente.
|
La distancia entre las partículas es aún mayor que en los líquidos. Se puede decir que las partículas en un gas tienen poca interacción entre ellas, sin embargo colisionan constantemente. Debido a eso se mueven por todas partes. Por esta razón son capaces de llenar todo el recipiente que las contiene.
Las partículas tienen mayor energía cinética que en los otros estados de agregación.
|

Propiedades de la materia
Las propiedades de la materia corresponden a las características específicas por las cuales una sustancia determinada puede distinguirse de otra. Estas propiedades pueden clasificarse en dos grupos:
a) Propiedades físicas: dependen fundamentalmente de la sustancia misma. Pueden citarse como ejemplo el color, el olor, la textura, el sabor, etc.
b) Propiedades químicas: dependen del comportamiento de la materia frente a otras sustancias. Por ejemplo, la oxidación de un clavo (está constituido de hierro).
Las propiedades físicas pueden clasificarse a su vez en dos grupos:
1. Propiedades físicas extensivas: dependen de la cantidad de materia presente. Corresponden a la masa, el volumen, la longitud.
2. Propiedades físicas intensivas: dependen sólo del material, independientemente de la cantidad que se tenga, del volumen que ocupe, etc. Por ejemplo, un litro de agua tiene la misma densidad que cien litros de agua
Estados físicos de la materia
En condiciones no extremas de temperatura, la materia puede presentarse en tres estados físicos diferentes: estado sólido, estado líquido y estado gaseoso.
Los sólidos poseen forma propia como consecuencia de su rigidez y su resistencia a cualquier deformación. La densidad de los sólidos es en general muy poco superior a la de los líquidos, de manera que no puede pensarse que esa rigidez característica de los sólidos sea debida a una mayor proximidad de sus moléculas; además, incluso existen sólidos como el hielo que son menos densos que el líquido del cual provienen. Además ocupan un determinado volumen y se dilatan al aumentar la temperatura.
Esa rigidez se debe a que las unidades estructurales de los sólidos, los átomos, moléculas y iones, no pueden moverse libremente en forma caótica como las moléculas de los gases o, en menor grado, de los líquidos, sino que se encuentran en posiciones fijas y sólo pueden vibrar en torno a esas posiciones fijas, que se encuentran distribuidas, de acuerdo con un esquema de ordenación, en las tres direcciones del espacio.
La estructura periódica a que da lugar la distribución espacial de los elementos constitutivos del cuerpo se denomina estructura cristalina, y el sólido resultante, limitado por caras planas paralelas, se denomina cristal. Así, pues, cuando hablamos de estado sólido, estamos hablando realmente de estado cristalino.
Los líquidos se caracterizan por tener un volumen propio, adaptarse a la forma de la vasija en que están contenidos, poder fluir, ser muy poco compresibles y poder pasar al estado de vapor a cualquier temperatura. Son muy poco compresibles bajo presión, debido a que, a diferencia de lo que ocurre en el caso de los gases, en los líquidos la distancia media entre las moléculas es muy pequeña y, así, si se reduce aún más, se originan intensas fuerzas repulsivas entre las moléculas del líquido.
El hecho de que los líquidos ocupen volúmenes propios demuestra que las fuerzas de cohesión entre sus moléculas son elevadas, mucho mayores que en el caso de los gases, pero también mucho menores que en el caso de los sólidos. Las moléculas de los líquidos no pueden difundirse libremente como las de los gases, pero las que poseen mayor energía cinética pueden vencer las fuerzas de cohesión y escapar de la superficie del líquido (evaporación).
Los gases se caracterizan porque llenan completamente el espacio en el que están encerrados. Si el recipiente aumenta de volumen el gas ocupa inmediatamente el nuevo espacio, y esto es posible sólo porque existe una fuerza dirigida desde el seno del gas hacia las paredes del recipiente que lo contiene. Esa fuerza por unidad de superficie es la presión.
Los gases son fácilmente compresibles y capaces de expansionarse indefinidamente.
Los cuerpos pueden cambiar de estado al variar la presión y la temperatura. El agua en la naturaleza cambia de estado al modificarse la temperatura; se presenta en estado sólido, como nieve o hielo, como líquido y en estado gaseoso como vapor de agua (nubes).
Materia viva e inerte
La Tierra alberga a muchos seres vivos, como son las plantas y animales. Una mariposa parece algo muy distinto de una piedra; sin embargo, ambas están compuestas de átomos, aunque éstos se combinan de manera diferente en uno y otro caso. Lamayor parte de la materia es inanimada; es decir, no crece, ni se reproduce, ni se mueve por sí misma. Un buen ejemplo de materia inanimada lo constituyen las rocas que componen la Tierra.
Cambios de la materia
Los cambios que puede experimentar la materia se pueden agrupar en dos campos:
Los cambios físicos son aquellos en los que no hay ninguna alteración o cambio en la composición de la sustancia. Pueden citarse como cambios físicos los cambios de estado (fusión, evaporación, sublimación, etc.), y los cambios de tamaño o forma. Por ejemplo, cuando un trozo de plata se ha transformado en una anillo, en una bandeja de plata, en unos aretes, se han producido cambios físicos porque la plata mantiene sus propiedades en los diferentes objetos.
En general, los cambios físicos son reversibles, es decir, se puede volver a obtener la sustancia en su forma inicial
Los cambios químicos son las transformaciones que experimenta una sustancia cuando su estructura y composición varían, dando lugar a la formación de una o más sustancias nuevas. La sustancia se transforma en otra u otras sustancias diferentes a la original.
La mayoría de los cambios químicos son irreversibles. Ejemplos: al quemar un papel no podemos obtenerlo nuevamente a partir de las cenizas y los gases que se liberan en la combustión; el cobre se oxida en presencia de oxígeno formando otra sustancia llamada óxido de cobre. Sin embargo, hay otros cambios químicos en que la adición de otra sustancia provoca la obtención de la sustancia original y en este caso se trata de un cambio químico reversible; así, pues, para provocar un cambio químico reversible hay que provocar otro cambio químico.
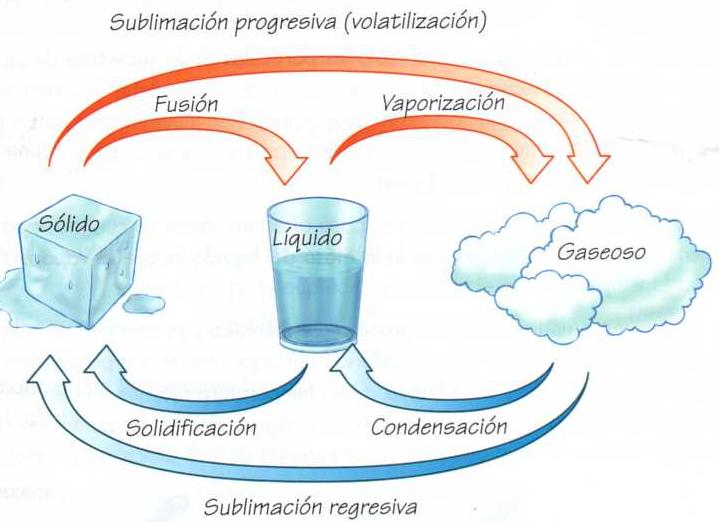
La materia cambia de estado físico según se le aplique calor o se le aplique frío.
Cuando se aplica calor a los cuerpos se habla de Cambios de estado Progresivos de la materia. Cuandolos cuerpos se enfrían se habla de Cambios de estado Regresivos.
Los cambios de estado progresivos son:
• Sublimación Progresiva
• Fusión
• Evaporación
1. Sublimación progresiva: Este cambio se produce cuando un cuerpo pasa del estado sólido al gaseoso directamente. La sublimación progresiva sólo ocurre en algunas sustancias, como, el yodo y la naftalina.
2. Fusión. Es el paso de una sustancia, del estado sólido al líquido por la acción del calor. La temperatura a la que se produce la fusión es característica de cada sustancia. Por ejemplo la temperatura a la que ocurre la fusión del hielo es O° C mientras la del hierro es de 1.525° C. La temperatura constante a la que ocurre la fusión se denomina punto de fusión.
3. Evaporación. Es el paso de una sustancia desde el estado líquido al gaseoso. Este cambio de estado ocurre normalmente a la temperatura ambiente, y sin necesidad de aplicar calor. Bajo esas condiciones, sólo las partículas de la superficie del líquido pasarán al estado gaseoso, mientras que aquéllas que están más abajo seguirán en el estado inicial. Sin embargo, si se aplica mayor calor, tanto las partículas de la superficie como las del interior del líquido podrán pasar al estado gaseoso. El cambio de estado así producido se denomina ebullición. La temperatura que cada sustancia necesita para alcanzar la ebullición es característica, y se denomina punto de ebullición. Por ejemplo, al nivel del mar el alcohol tiene un punto de ebullición de 78,5° C y el agua de 100°C.
La temperatura a la que ocurre la fusión o la ebullición de una sustancia es un valor constante, es independiente de la cantidad de sustancia y no varía aún cuando ésta continúe calentándose.
El punto de fusión y el punto de ebullición pueden considerarse como las huellas digitales de una sustancia, puesto que corresponden a valores característicos, propios de cada una y permiten su identificación.
Los cambios de estado regresivos de la materia son:
• Sublimación regresiva
• Solidificación
• Condensación
1. Sublimación regresiva. Es el cambio de estado que ocurre cuando una sustancia gaseosa se vuelve sólida, sin pasar por el estado líquido.
2. Solidificación. Es el paso de una sustancia desde el estado líquido al sólido. Este proceso ocurre a una temperatura característica para cada sustancia denominada punto de solidificación y que coincide con su punto de fusión.
3. Condensación. Es el cambio de estado que se produce en una sustancia al pasar del estado gaseoso al estado líquido. La temperatura a que ocurre esta transformación se llama punto de condensación y corresponde al punto de ebullición de dicha sustancia. Este cambio de estado es uno de los más aprovechados por el hombre en la destilación fraccionada del petróleo, mediante la cual se obtienen los derivados como la parafina, bencina y gas de cañería

Te dejo el siguiente video para que hagas tu torre de líquidos y lo presentes en clase para que te ganes participaciones. Hazlo!!!!!
Construye tu lámpara de lava y preséntala en clase
También te dejo el siguiente video para que construyas esta lámpara con luz de neón si no te gustó la anterior. Suerte!!!!
Suscribirse a:
Comentarios (Atom)
Niños felices, escuela feliz, mundo feliz